Molekulárně genetická diagnostika v mikrobiologii
Mám strach o můj oblíbený obor – lékařskou mikrobiologii.
Aneb kacířská úvaha o užitečnosti dnes módních molekulárně genetických metod v lékařské mikrobiologii.

Zakladatel lékařské mikrobiologie německý lékař
ROBERT KOCH(1843-1910)
Nobelova cena za lékařství v r.1905
zdroj foto internet
Je to jistě zvláštní,když řadový pracovník, pouhý laborant si dovolí upozornit na vývoj oboru,který je pro něj profesí.Od dob kdy jsem navštěvoval základní školu jsem o svém zaměstnání měl jasno. Na rozdíl od rodinné tradice, kde se celé generace střídali truhláři,kováři a zámečníci jsem chtěl být zoologem.Patrně jsem se začal specializovat příliš brzy.Možná i shodou okolností, možná i původem a jinými okolnostmi jsem skončil jinde.Devítiletku jsem s končil se samými jedničkami, přesto mi hrozili, že se nedostanu ani na obor rodinné tradice – zámečníka. Vystudoval jsem však střední školu zaměřenou na biologii a chemii (dnes fakultní gymnázium Př.f. UK).Na vytouženou přírodovědeckou fakultu ke studiu zoologie jsem se však nedostal.Musel jsem na dva roky na vojnu. Co pak po vojně. Zkusil jsem opět vysokou bez úspěchu.
Mikroorganismy byly také pro mě malými zvířátky a tak jsem šel na zdravotnickou školu na obor mikrobiologický laborant. Mimo obsah středoškolského studia jsem si studoval mikrobiologii v širším měřítku.Od roku 1971jsem vždy pracoval mezi odborníky na lékařskou mikrobiologii. Měl jsem možnost poznat různé obory této krásné a zajímavé specializace a vynikající odborníky v oboru.Vše bylo pro mě nové, vše mě zajímalo a připadalo mi to také velmi účelné. Mohli jsme pomáhat při nemocech konkrétním lidem. Všechno mělo svůj smysl. Díky mým nadřízeným jsem mohl provádět i vlastní pokusy, které mě přiblížili další a další metody diagnostiky lékařské mikrobiologie.Měl jsem možnost osobně poznat velikány české lékařské mikrobiologie, kteří pracovali ve Státním zdravotním ústavě.Nejen to, že jsem je potkával, ale měl jsem často možnost vidět jejich práci, konzultovat s nimi problematiku, dokonce i s nimi spolupracovat.Jako člen České lékařské společnosti JEP mikrobiologické a onkologické společnosti jsem nadšeně navštěvoval velmi často úterní semináře v Lékařském domě.
Fotografie R.Kocha z mladších let.(Z publikace Dr.Dubose)
Bohužel jsem též viděl první neblahé politické změny, které zasáhly i do vývoje diagnostiky lékařské mikrobiologie.Do svého prvního zaměstnání jsem nastoupil hned po skončení školy, byla to však doba Husákovi normalizace po událostech v roce 1968. I do mikrobiologie zasáhla politika. Prověrkové komise rychlokvašených mikrobiologických „odborníků“ zcela rozvracely vedení všech hygienických odborů v tehdejším Institutu hygieny a epidemiologie.Nestora naší epidemiologie a zakladatele sítě hygienických stanic Profesora Karla Rašku sprostým způsobem doslova vyhnali z jeho ústavu. Na nadarmo se říkalo Centru epidemiologie a mikrobiologie „Raškárna“.To je něco z cesty k tomuto článku.
Z historie lékařské mikrobiologie víme že první poznatky o mikroorganismech byly spíš v důsledku zálib zvědavých lidí.Zde má na mysli pokusy obchodníka A.van Leeuwenhoeka(závěry pozorování z let 1683 a 1692) Později byly mikroorganismy v centru dohad teorie o samoplození. Dlouho se nepodařilo získat sterilní prostředí, kde by dříve nebo později mikroorganismy nevyrostly. Chemik L.Pasteur svými pokusy ukončil diskusi o možném samoplození živých organismů. Přitom využil výsledky svých pokusů v kvasné výrobě. První kdo prakticky založil lékařskou mikrobiologii byl Pasteurův vrstevník Robert Koch. (Nobelova cena za lékařství 1905)Po jeho pokusech, kdy objevil řadu mikroorganismů které způsobovaly lidská onemocnění, počínaje slezinou snětí a konče tuberkulózou nastal velmi prudký rozvoj tohoto oboru. Díky tomu bylo zachráněno lidstvo před decimací infekčními nemocemi. Pro mě je zajímavý vývoj diagnostických metod při srovnání se současnou situací.
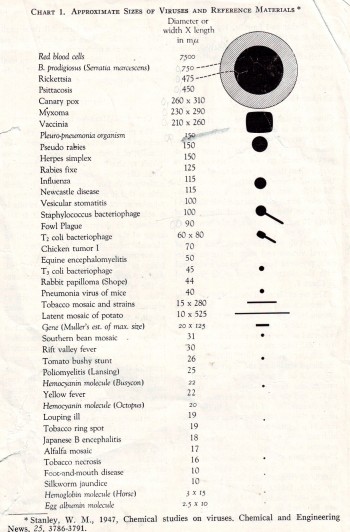
1.Mikroskopie
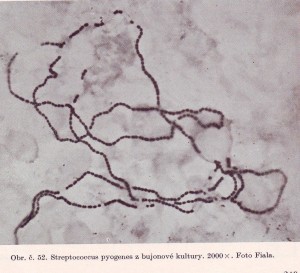
Předpokladem objevení mikroorganismů byla optická zvětšovací technika která umožnila zvětšení v počátcích od 40 po 400 násobného zvětšení.Právě toto zvětšení již umožnilo zjišťovat mikroorganismy v přírodě i v živočiších a lidském organismu.Pro zlepšení viditelnosti drobných organismů se díky Robertu Kochovi a jeho vrstevníků nalezla řada barviv a postupů barvení. Zjistili se tak větší podrobnosti o tvaru pozorovaných organismů.
Začala se též éra systematické mikrobiologie, rozřazovaní bakterií a jiných mikroorganismů do skupin většinou podle morfologické podobnosti. Tehdy zavedené metody přehledné mikroskopie se udržely do nedávna.Kdysi bylo běžné, že lékař provedl výtěr, který ihned obarvil a na svém mikroskopu pozoroval. Lehce tak bez ztráty času zjistil původce tehdy závažných až smrtelných onemocnění jako byla spála, angína,záškrt,stafylokoková infekce,snět,mykotické infekce i tuberkulózu.Byla to i metoda semikvatitativní, která umožnila určit velmi rychle etiologické agens .
Optická mikroskopie se zdokonalovala ale byla omezena maximálním zvětšením do 2000 násobného. Vznikaly však i ultramikroskopy, metody pozorování objektů v temném poli, v UV světlu atd. Speciální optická mikroskopie se používá dodnes a je to stále velmi prospěšná metoda v mikrobiologii. Bohužel rychlá metodika přehledného barvení a mikroskopické diagnostiky v lékařské ordinaci téměř zmizela. Je to opravdu škoda, důsledkem je ztráta času s často kritickými následky. Dnes kdy jsou k dispozici dokonalé optické mikroskopy, cenově dostupné se využívají pouze při školometné výuce lékařských oborů.
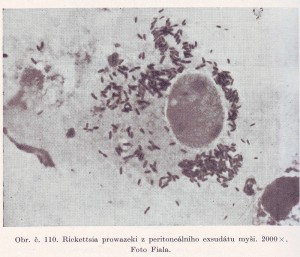
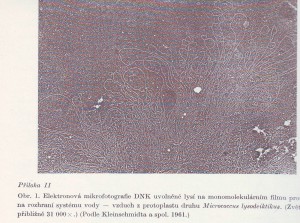
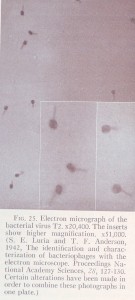
Objev menších organismů, než jsou nejmenší mikroorganismy viditelné při největším zvětšení v optickém mikroskopu (velké viry,rickettsie) pomohla zkoumat elektronová mikroskopie. Problémem zde však je příprava použitelného preparátu. Preparáty pozorované ve vysokém vakuu musí,být velmi tenké, nebo speciálně barvené. Nicméně přes všechny potíže se zdá, že právě elektronová mikroskopie může být velmi rychlou perspektivní metodou jak určit druh virusů a malých mikroorganismů. Problémem však je správně se orientovat zda jde o náhodný nález několika virových partikulí nebo nález takového množství těchto partikulí v klinickém materiálu který potvrzuje právě probíhající akutní onemocnění.
2.Kultivace
Převratným objevem dnes již velmi starým bylo zjištění, že je možné většinu mikroorganismů (mimo těch žijících uvnitř buněk)kultivovat na umělých mediích. Někdy dokonce na chemicky definovaných mediích.
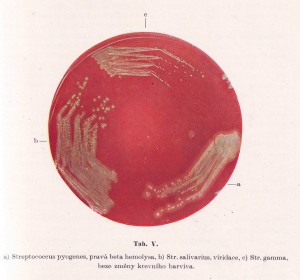
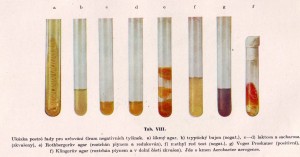
Od tekutých živných roztoků se přešlo i k pevným živným půdám. Agarové pevné živné půdy umožnily dříve nevídanou možnost. A to nechat vyrůst z jediné bakteriální buňky kolonii identických mikroorganismů.Tak bylo možné na povrchu pevného media rozlišit i jednotlivé druhy mikroorganismů.
Díky diferenciálním mediím pak bylo možné přesně určit již v prvním rozboru druh organismu podle odlišného zbarvení a morfologie, nebo dokonce byly zhotovovány selektivní půdy na kterých rostly pouze hledané mikroby.Získaly se tak čisté kmeny mikroorganismů, a bylo možné lehce stanovit i množství životaschopných jedinců v jakémkoliv tekutém mediu. Zde však je též první problém.Morfologie,často i biochemické vlastnosti často neodpovídaly formám které žily v organismu nebo ve volné přírodě. Izolace čistých kmenů bohužel často netušeně vedla k izolaci odlišných variant, subkmenů a genetických mutací, které se dost lišily od původních původců onemocnění.Z mohých se pak staly „standardní“ laboratorní a sbírkové kmeny, které se dost liší od svých předků jak virulencí tak i mnoha dalšími vlastnostmi. Je to jakýsi předobraz rozboru genetického obsahu mikroorganismů v dnešní době. Se stejnými důsledky ale o tom později.
Sken receptáře SZÚ z roku 1927
dar PhMr.Josefa Mottla,CSc.
Kultivační metodika dosáhla vysoké spolehlivosti a dokonalosti. Byly dokonce vyráběny jednoduché sety pro nenáročnou kultivaci přímo v ordinaci. Tak si mohl například urolog sám udělat představu do 24 hodin o tom který druh bakterie v moči pacienta převládá a dokonce i které antibiotikum na něj nelépe působí. To se týkalo řady vyšetření nejen moči. Bohužel většina lékařů raději spoléhá na vyšetření ve specializované laboratoři, které je však většinou daleko dražší někdy i zbytečně podrobné a výsledek přichází i se zpožděním.
Kultivace intracelulárních bakterií a virů byla specifickou problematikou. Kultivace se prováděla v tkáňových kulturách.Náročné podmínky pro kultivaci různých vnímavých tkání, snadná kontaminace kultur balteriemi, plísněmi i mykoplasmaty prakticky znemožnily používat zkoumaný klinický materiál pro delší kultivace.Nicméně dosud tato metoda není nahraditelná při produkci velkého množství virových partikulí a intracelelárních bakterií které se pak používá k vakcinaci nebo pro výrobu diagnostik.
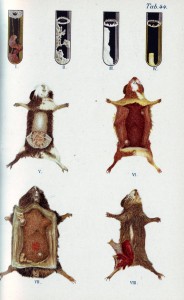
5.Pokus na zvířeti.
Pokus na vnímavém zvířeti se velmi brzy ujal jako diagnostické kritérium pro potvrzení diagnózy.Byl nezbytný při každém novém průkazu pathogenity mikroorganismu. Tkáně živých zvířat pak v některých případech byly jedinou možností kde růstově náročného mikroba namnožit.Dokonce i v opačném případě "čistění" vzorku od kontaminujích doprovodných organisnů bylo naočkování vzorku na zvíře často používáno. Pokusy na laboratorních zvířatech zachránily mnoho lidských životů a pomohly bezpečně rozeznávat druh pathogenity a vnímavé orgány, které byly působením mikroorganismů poškozeny. Také velmi brzy po zjištění, že odolná zvířata vytvářejí použitelná množství protilátek a antitoxínů proti nebezpečným bakterií a jedům se masově začala zvířata používat pro přípravu léčebných i diagnostických přípravků. Těmto "obětem" vědy musíme být vděčni za mnohé. Bohužel díky falešným představám ochránců zvířat i proto, že pokus na zvířeti byl lecky obtížný i nebezpečný zaniká tento obor mikrobiologické diagnostiky.Bohužel se nedá jinak nahradit. Nově objevované nemoci bohužel již často touto deformací trpí. Příkladem může být i lymeská borrelióza, chlamydiové infekce a řada nových onemocnění způsobená nově objevovanými viry. Při těchto nemocích se často vytrácí nezbytná část diagnostiky a zkoumání potogeneze z pokusů na zvířeti.Zbytečná rychlost výzkumu a snad i nešvar naší doby ve formě charakterových vad badatelů a objevitelů "být první za každou cenu" snižuje neotřesitelnost původních nálezů. Vynecháním dlouhodobých a precizních testů na zvířeti nástávápak u těchto "módních" infekcí období skepse, nevěrohodnosti specifických klinických příznaků i diagnostické rozpaky.Někdy to končí i tím, že se nakonec se všichni smíří s tím, že všechno je jinak, nebo se odvrátí pozornost k dalšímu modnímu etihologickému agens.Příkladem může být lymeská borrelioza, jejíž původce byl objeven objeven v roce 1982 v klíštěti v americkém klíštěti Ixodes dammini. Byly využity růzdé mikrobiologické diagnostické metody včetně těch nejmodernějších z oblasti nové molekulárně diagnostických metod.Snad pro obtížnou kultivovatelnost původců, snad i pro přeceňování moderních metod nebyl zcela dokončen pokus na zvířeti, definice pathogenního působení na různé tkáně člověka, stanovení virulence,infekční dávky, vnímavosti. Vše to vedlo k pozdějším diagnostickým pochybnostem, novým klasifikacím a mnohé pochybnosti a nejasnosti tak zůstávají dodnes.Zdá se že nebyly ani dodrženy osmdesát let staré požadvky Roberta Kocha k uznání specifity původce onemocnění:
Základní podoba Kochových postulátů( podle Wikipedie)
1.Mikroorganismus musí být pozorován ve všech nemocných jedincích a v žádném zdravém.
2.Musí být izolován z nemocného jedince a vypěstován mimo něj v laboratoři v čisté kultuře.
3.Zdravý pokusný objekt musí po naočkování dostatečného počtu jedinců této čisté kultury onemocnět a vykazovat stejné příznaky onemocnění jako v bodě 1.
3.Z tohoto onemocnělého pokusného objektu musí být izolován mikroorganismus identický s tím, který byl pozorován a izolován v původním nemocném jedinci.
4. Biochemické růstové testy
Ihned po izolaci čistých kultur byla zkoumána biochemická aktivita jednotlivých druhů mikroorganismů.Od běžného aerobního zkvašování nejrůznějších druhů jednoduchých i složitých cukrů,vytváření různých plynů, oxidaci, anaerobní utilizaci cukrů,štěpení,až po dekarboxylaci a štěpení DNA.Tím se dostala do rukou mikrobiologů vynikající diagnostická pomůcka, která umožnila identifikovat i jednolivé kmeny v rámci jednoho druhu mikrorganismu. V nadšení nad moderní diagnostikou se stále zdokonalovaly biochemické diferenciální testy jednak cestou miniaturizace testů a jednak zvyšování citlivosti testů. Zde nastalo též několik úskalí. Při zvyšování citlivosti bylo zjištěno nakonec, že takový extrémě citlivý test vlastně znemožnˇuje jeho použití. Bylo to tím, že zvýšením citlivosti nakonec všechny mikroorganismy vytvářely hledaný produkt.
Příkladem může být tvorba sirovodíku, důležitého diferenciálního znaku řady pathogenních střevních organismů. Stačilo přidat bílkovinné štěpy s vysokým obsahem takových aminokyselin jako je cystein a které obsahují nadbytek síry a byly všechny testy pozitivní. Dalším problémem bylo, že náročnější organismy neprodukovaly hledané sloučeniny jen proto, že substrát nebyl dost výživný, případně, že obsahoval toxické sloučeniny, např. ve formě indikačních barviv. Dokonce se objevily v rámci jednoho definovaného druhu mikroorganismů kmeny, které se chovaly naprosto opačně něž jak by se čekalo. Tyto problémy se zvyšovaly až nakonec zčásti se toto diferenciální schéma biochemických testů dlouhých i krátkých řad opustilo. Je však nutné řici, že dosud se vybrané biochemické testy používají, vyžaduje to však stadardizaci jejich přípravy a používání.Pro běžnou klinickou praxi jsou uvedené testy dostačující, rychlé i spolehlivé. Pro výzkumnou práci pro epidemiologické studie a hledání nových druhů a rodů se metoda však používá stále méně.
5. Serologie
Od poměrně již velmi starého předpokladu a doložených pozorování i z období středověku, možná že i dříve, bylo jasné že prodělání některých infekcí vede k odolnosti proti stejné nemoci. Konkrétní průkaz produkce specifických i nespecifických protilátek byl spojen s experimentální infekcí u pokusných zvířat. Zdánlivá specificita, vysoká citlivost a reprodukovatelnost vyzdvihly serologii na přední místo mikrobiologické diagnostiky. Navíc úspěšné pokusy s použitím protilátek i antisér u nemocných pokusných zvířat a nakonec i v léčbě nemocných lidí přivedly řadu mikrobiologů ke zdokonalení serologické diagnostiky. Vyvinula se řada významných diagnostických metod, které spojovaly dokonce i optickou i a elektronovou mikroskopii a imunologii. Imunologie využila například v difůzní precipitaci, při elektroforetické identifikaci protilátek, hemaglutinaci, precipitaci antigenu, nepřímou i přímou imunofluorescenci atd.Citlivost metod byla dovedena k vysokému standardu. Problém byl a je se specifitou většinou celkových a směsných antigenů. Studium imunologie přineslo do diagnostiky i uměle produkované monoklonální látky, které zaručovaly vysokou specifitu při potřebné citlivosti. Diagnosticky byly někdy využity i nespecifické imunologické reakce například využití povrchového antigenu gramnegativní bakterie rodu Proteus při identifikaci protilátek při onemocnění rickettsiemi a podobně při Bordet-Wassermannově reakci při onemocnění spirochétou rodu Treponema.
1927
Narůstajícím problémem je však odlišný antigen v rámci jednoho rodu a dokonce i druhu. Příkladem je serologická diagnostika původce lymeské borreliózy. Pro stanovení pozitivní reakce ELISOU (nejpoužívanější serologická metoda s enzymatickou vazbou)je nutné pro každý genospeciés použít specifický směsný antigen t.j. antigen připravený z kmene Borrelia burgdorferi , Borrelia garinii, Borrelia afzelii (VS461),i dalších například ze skupiny VS116 atd.To znamená provádět odděleně tři až čtyři testy současně u jednoho klinického vzorku. V praxi je to neúnosné.Navíc když si uvědomíme, že například Borrelia garinii má několik sérotypů a jen jeden z nich je prokazatelně pathogenní, přináší to řadu dalších problémů. Navíc při směsném antigenu nelze vyloučit reakci s tzv. šokovým antigenem, reumatoidním "faktorem" atd. Přítomnost takových a podobných nespecifických antigenů v klinickém materiále způsobuje pak i v tak dokonalé serologické metodě problémy. Pro odstranění uvedených problémů účinně pomáhá elektroforeticky rozdělený antigen ,který využívá imunoblot.I zde je však třeba vysoké odbornosti pro správnou interpretaci výsledků. I zde mohou vznikat nespecifity a je nutné sérum předem vysycovat různými způsoby, pečlivě udržovat pH reakce která může ovlivnit citlivost např. prchavým vybarvením. Problémy jsou i při vzniku komplexů protilátek, které pak není možné bez jejich štěpení prokázat. Užitečná metoda například při průkazu humorálních protilátek u lymeské borreliózy je diagnostika pomocí metody imunokoplexů. Metod jak prokazovat humorální protilátky i antigen v tkáních pacienta je celá řada. Například enzymatické imunochemické metody průkazu agens v histologických preparátech ,na krevních roztěrech ,na tkáňových otiscích atd. Všechny i serologické metody jsou však zatíženy též problémem variability použitého a stále se měnícího antigenu. Ještě větší problémy nastávají pokud je pro diagnostiku používán "standardní" starý a sbírkový druh mikroorganismu pěstovaný a uchovávaný dlouhou dobu v umělých mediích.
Velkým přínosem pro diagnostiku i léčbu(některá nádorová onemocnění aj) byl objev možné syntézy monoklonálních protilátek.Dne s užívaný v diagnostice závažných onemocnění např. u hepatitidy a AIDS.Dále se používají v diagnostice různých antigenů a toxínů. (Nobelova cena za lékařství 1984 Kohler,G.J.F.,Milstein,G.)
1948
6.Fagotypizace
Velkým objevem byl nález organismů které způsobovaly onemocnění a lýzu jednotlivých bakteriálních buněk i celých jejich populací.(po roce 1910) I bez elektronového mikroskopu neviditelné organismy selektivně napadaly i ty nejpatogenejší bakterie. Svitla velká naděje že bude možné pomocí různých bakteriofágů (v překladu žroutů bakterií) lehce vyléčít jakákoliv bakteriální infekce. Studium mechanismu jak toho bakteriofágů dosahují poprvé vneslo úvahu o genetickém matrix které vpraveno do bakteriální buňky nakonec vyvolá rozpad bakterie.Studium v oblasti nad největší rozlišitelností optického mikroskopu přineslo nové poznatky též o největších virech. Do té doby pokládali někteří badatelé viry za neživé struktury, které mohly i krystalizovat.
.Prostorové uspořádání v podobě pravidelných geometrických tvarů u bakteriofágů a virů dokonce vedlo k úvahám, že se jedná o neživé krystalické struktury.
Diskuse na toto téma nebránila dalšímu studiu bakteriofágů. Kupodivu se přišlo na to, že největším zdrojem různých bakteriofágů jsou odpadové vody. I jejich izolace byla poměrně jednoduchá. Odpadní voda se přefiltrovala bakteriálním filtrem nebo sintrem o velikosti pórů maximálně 0,2 u.Filtrát neobsahoval většinou žádné bakterie, zato viry a bateriofágy v této tekutině zůstaly životaschopné. Poté stačilo na misku s živnou půdou naočkovat vybranou bakterii masivně po celém povrchu.Po zaschnutí povrchu se pak odděleně přidávaly po kapce různé fitráty odpadních vod. V roztoku kde byl specifický bakteriofág, který napadal druh naočkované bakterie se vytvořila zóna projasnění bez růstu bakterie. Výsledek byl podobný jako při difuzní metodě zjišťování citlivosti na antibiotika pomocí disků. Velké množství fágů se pak získávalo opět poměrně jednoduše.Do tekuté narostlé kultury určité bakterie se naočkoval specifický bakteriofág. Po kultivaci došlo k rozpadu všech bakteriálních buněk a zůstala zde namnožená vysoká koncentrace bakteriofágů v téměř v čirém medium.
Již v této formě se mnohdy lysát používal k léčbě a prevenci. Ve čtyřicáctých letech minulého století vznikla v Rusku pod patronátem J.V.Stalina továrna na výrobu bakteriofágů pro léčebné účely.I u nás se dosahovalo překvapivých výsledků při léčbě mnoha onemocnění. Vzpomenu například ze Státního zdravotního ústavu v Praze MUDr.Františka Výmolu, který právě bakteriofágem zachránil mnoha pacientům končetiny zachvácené bakteriemi rezistetními na antibiotika, a měly proto podstoupit amputaci končetin.Netrvalo dlouho po objevu bakteriofágů aty byly využity v mikrobiologická diagnostika. Vznikla tak zajímavá metoda fágotypizace.
Sám jsem viděl jak se dá této metody velmi dobře použít i při epidemiologckých studiích. Metodu pro fagotypyzaci salmonel a stafylokoků využívali ve prospěch pacientů sestry MUDr.Matějovské z našeho ústavu. Taktéž jsem viděl úspěšnou fagotypizaci mykobakterií na pracovišti Doc.MUDr.J. Šůly též v SZÚ.Tyto velmi prospěšné metody byly opuštěny právě po zavádění nových molekulárně genetických metod v diagnostice. Nakonec kdysi byl na našich pultech k dostání lysát z bakterií, které způsobují respirační onemocnění ve formě medicinální žvýkačky SEVAC. Lysáty byly používány i v mastech na ošetření hemoroidů a jiné přípravky.
Sken původního receptáře Varny živných půd SZÚ Praha z roku 1927
1948
Nečekané zjištění že bakteriofág může přenášet i cizí DNA bylo začátkem konce této metody.Varujícím zjištěním bylo, že teraupeticky požívaný fág změnil běžnou bakterii střevního traktu Escherichia coli na bakterii, která produkovala silný toxín. Po dalším průzkumu byla pak fagoterapie téměř opuštěna a fagotypizace mizí z mikrobiologické diagnostiky.
1965
7. Molekulárně genetická diagnostika

G.Mendel
Variabilita kultivovaných mikroorganismů pěstovaných na umělých živných půdách se stala záhadou, kterou se začala zabývat řada mikrobiologů. Až do této doby (1925) se nepředpokládalo, že i tak drobné mikroorgasnimy podléhají genetickým zákonům jak byly popsány u rostlin a živočichů.
V ojedinělých zjištěních již v roce 1928 bylo upozorněno na důkaz přenosu genetické informace která byla popsána jako transformace u pneumokoků.(Obdoba sexuálních procesů u vyšších organismů)Posléze se podařily první experimentální rekombinace u bakterie Escherichia coli.Vznikaly první pokusy pro rozlišení skupin organismů podle obsahu jednotlivých nukleotidů v DNA .Genetici přivítali nové experimetální modely ve formě rychle a snadno se množících mikroorganismů.Mikrobiologům se podařilo po šetrné lýse znázornit vlákna DNA pomocí elektronové mikroskopie. Autoradiografie a další moderní techniky výzkumu na molekulární úrovni zmapovaly první bakteriální chromozomy a prostorovou struktury základní stavby DNA.
Poznatky z oblasti replikace DNA vedly k praktickým pokusům o umělou syntézu krátkých úseků nukleových kyselin. Studium specifických sekvencí DNA v chomozómech bakterií rychle vedlo k vytvoření diagnostických metod, které se využívaly pro amplifikaci takových úseků DNA bakterií, které se lišily od ostatních druhů.Původní potíže při praktickém využití metody z velké části odstranil objev termostabilního enzymu, který syntetizoval vlákno nukleové kyseliny v dostatečném množství ,které bylo poté po obarvení a vizualizaci v UV světle a po srovnání s velikostním DNA markerem použitelné pro diagnostiku.
Byla objevena, a hned také patentována metoda polymerázové řetězové reakce. Její použitelnost byla univerzální. Jak to bývá i ona měla svá omezení. Zpočátku to byla kvalita použitých složek reakční směsy,strikní stanovení podmínek teplotního profilu reakce.

Dr.K.Mulis objevitel PCR v r.1985
Nobelova cena za chemii v r.1993
Problémem byl i vznik nespecifických produktů a hromadění chybných syntéz se stoupajícím počtem opakujících se cyklů reakce.Bylo nutné zavést kontrolu, jak dnes říkáme identifikaci produktu reakce. Byly vytvořeny přesné kontrolní metody ať už to byly enzymatické reakce, které štěpily produkt na specifické menší amplifikáty. To se jedná o restrikční analýzu.(Nobelova cena za lékařství 1978 Smith,H.O.,Aber,W.,Natans,D.) Dále další reakce již běžně používána bylo připojení kontrolního nukleotidu formou hybridizace a nakonec i rozbor produktu na jednotlivé nukleotidy a jejich frekveci - sekvenaci.(Nobelova cena za chemii 1980 Gilbert W.)
Pro metody PCR bylo vyvinuta řada vylepšení: Horký start reakce, citlivější nested PCR a seminested PCR, PCRq kvantitativní a v reálném čase atd.Též byly zavedeny další molekulárně genetické reakce, které umožnily klonování výrobu rekombinantních komponet pomocí mikroorganismů a objev metod vedoucí k vnášení dalších nových vlastností do vybraných mikroorganismů pomocí genů, plasmidové DNA atd.
pokus o reálný vzhled DNA v jádru
Zdánlivě molekulárně genetická diagnostika vyřešila identifikaci většinou těžce kultivovatelných nebo i nekultivovatelných mikroorganismů. Bohužel metoda byla využita i tam, kde lepší předmětem volby byla klasická kultivace a následná biochemická diferenciace.Jedna z velmi neblahých vlastností při amplifikaci produktů, je vznik krátkých úseků DNA v obrovitém množství (z jedné molekuly předlohy se po 35 reakcích PCR vytvoří 85 % 2 na třicátou amplikonu!). Při každém otevření reakční zkumavky je reálné nebezpečí úniků molekul produktu do okolí. Při dodržování sterility prostředí se bráníme před mikrorganismy,plísněmi a jejich spórami. U PCR je však nutné se bránit před volnými molekulami a to je podstatně těžší někde naprosto nemožné. Důsledkem jsou falešně pozitivní reakce. Pokud není dostatečná kvalifikace, laboratorní návyky i chrakterové vlastnosti na potřebné úrovni lehce dochází ať nevědomě nebo vědomě k falešným výsledkům. Stejně tak snadné dosáhnout falešně negativní výsledků. Proto podle mého patří využívání metodiky PCR je do rukou zkušených laboratorních pracovníků a proces i pracovníci by měly být pod stálou několikanásobnou kontrolou.
Nadšení pro molekulárně genetické metody je dnes obrovské. Zdá se mi, že fakulty produkují většinu absolventů ,kteří chtějí pracovat právě s touto metodou. Nikdo nechce být serologem,klasickým mikrobiologem, každý chce pracovat "moderně a na světové úrovni" metodou PCR a s molekulárně genetickými metodami. Není nezajímavé, že z mikrobiologie se nám téměř ztratili muži-mikrobiologové, na jejich místadnes skoro výhradně nastupují mladé ženy pro které "smradlavá" klasická mikrobiologie je odpuzující a naopak "čistá a fainová" modní molekulární diagnostika je vítána.
V lékařské mikrobiologii je to vlastně tragedie. Důsledkem jsou i takové efekty histerického přístupu k "objevujícím se novým módním infekcím".jak je známe z posledních let.

SARS, ptačí chřipka,nemoc šílených krav aj.Moderní metody vedly netrpělivé a nezkušené k hledání nových, téměř pro bulvár vhodných nemocí.

Když poté se situace analyzuje , použijí se další přesnější metody pro identifikaci produktů PCR jde jen o humbuk, chyby diagnostiky a diagnostiků. A důsledky.Většinou strašné.Nakonec se hledá a jistě najde i další ještě módnější nemoc.

Zbytečné vybíjení desetitisíců zvířat, tramatizace, nedůvěra někdy i zbytečná léčba a samozřejmě obrovské finanční ztráty.

Nebezpečí širokého využití amplifikace DNA, štěpů DNA, plasmidů je i to, že do prostředí vzdušnou cestou a pomocí odpadních vod se šíří neobvykle velké množství různé DNA,jejích fragmentů a produkčních organismů což již dnes vytváří v našem životním prostředí "Genetický smog".Zdá se, že toto znečistění napomáhá novým mutacím v bakteriálních,rostlinných i živočišných buňkách. Nahromadění "genetického odpadu"může nakonec navodit i řadu nových "nemocí a postižení".Tato oblast není vůbec hygienicky dosud regulována a kontrolována, přitom asi již dnes velmi silně zaneřádila a jistě ještě v budoucnu zaneřádí naše životní prostředí, tak jak jsme toho svědky v labvoratořích zabývajících se uvedenou metodikou.
Jako člověk, který se věnuje mikrobiologii nejen během svých téměř 40 let zaměstnání v oboru, ale i ve většině svého volného času, si myslím že útěk klasických mikrobiologů do virtuálního světa molekulární diagnostik je nejméně alarmující. Takový "mikrobiolog" ani během celého svého profesního života žádnou bakterii způsobující lidské onemocnění pořádně nepozná. A to se mi zdá zcela diskvalifikující pro obor který prošel dvousetletým úspěšným vývojem a stal se již v minulosti nezbytný pro ochranu lidstva přes infekčními nemocemi. Molekulární diagnostika by měla být jen účelnou částí lékařské mikrobiologie za použití všech ostatních reálných metod tohoto oboru.
Mikrobiologové a jejich ocenění:
http://cs.wikipedia.org/wiki/Leeuwenhoekova_medaile
http://cs.wikipedia.org/wiki/Nobelova_cena_za_fyziologii_a_medicínu