Testy používané pro průkaz Borrelia burgdorferi.
Vyzkoušeli jsme v Národní referenční laboratoři pro lymeskou borreliózum, centra epidemiologie a mikrobiologie Státního zdravotního ústavu v Praze:
Souprava pro PCR diagnostiku Borrelia burgdorferi firmy GENEKAM Biotechnology AG“
Hulínská,D., Votýpka,J.A.
Státní zdravotní ústav Praha, Národní referenční laboratoř pro lymeskou borreliózu ,Centra epidemiologie a mikrobiologie
(20.5.2005)
Testovaná souprava:
„Borellia burgdorferi Ready to use PCR Kit“
Order-No.018, 100 reakcí za 299.0 €
Vyrábí: Genekam Biotechnology AG,
Dammstrasse 31-33, D-471199 Duisburg,Germany
Dováží do ČR: Biogen Praha s.r.o.
Ke Sv.Izidoru 2293/4a, 140 00 Praha 4, Chodov
1.0.Úvod
Diagnostika lymeské borreliózy je dnes postavena na odpovídajících klinických projevech s adekvátním serologickým nálezem při použití testů z ELISA a Westernblotu. Serologický průkaz přítomnosti původce lymeské borreliózy je dnes standardizován a při použití třetí generace rekombinantních antigenů se dosahuje až 90-95 % specifičnosti při citlivosti v I.stadium lymeské boreliózy 20-50%, ve druhém 70-90% a ve třetím 9-100 %. (1) Přesto,že přímý průkaz spirochét Borrelia burgdorferi (BB)je jednoznačně méně citlivý ,roste o něj ze strany lékařů a laboratorních pracovníků zájem. Menší citlivost je dána skutečností, že počet spirochét způsobujících lymeskou borreliózu je v tělních tekutinách velmi nízký i v akutních stádiích onemocnění. Nejčastěji se daří průkaz v kůži při EM(erythema migrans) a ACA (acroderamtitis acuta) a v synoviální tekutině (50-70 %). V akutním stádiu onemocnění bez léčby je možné prokázat DNA BB v plasmě do 30% případů, stejně tak u prokázané neuroboreliózy do 20 % v mozkomíšním moku. U chronických případů procento průkazu ještě klesá, zvyšuje se však při výskytu dalších virových a bakteriálních onemocnění pacienta, nebo při poklesu obranyschopnosti z jiných důvodů, i tak však nedosahuje více než 20 %.(2) Vlastní desetileté zkušenosti se shodují s výtěžností u tkání a ze synoviální tekutiny, záchyt v ostatních tělních tekutinách však vychází u našich pacientů jen v polovičních hodnotách.Komerční testy využívající amplifikaci specifických sekvencí oligonukleotidů pomocí polymerázové řetězové reakce ( PCR) určené pro průkaz BB s dostatečnou citlivostí a specifitou dosud na trhu nejsou k dispozici. Je to s podivem, neboť počet předpokládaných vyšetření by svědčil pro velký úspěch na trhu. Velké firmy(Roche,TaKaRa) dodavající na trh soupravy pro PCR diagnostiku různých infekčních onemocnění, kity pro lymeskou borreliózu nenabízí .Vyjimkou jsou soupravy pro techniku Real – Time PCR, které však předpokládají zhruba téměř miliónový náklad na pořízení thermocykleru a nemalé náklady na diagnostické kity. Dnes jsou k dispozici pro tuto techniku soupravy firmy TaKaRa BIO INC. ( pro Light Cykler) RealArt (tm) Borrelia PCR Kit (LC) AT 140 A ( http://www.takara-bio.co.jp/english/conts.htm ). Také firma Bio-Stat Diagnostics nabízí kit pro Light Cykler „Borrelia LC PCR Kit“ (http://www.bio-stat.com/), stejně tak firma ARTUS přichází s obdobným kitem pro rozlišení pěti genomospeciés BB „ RealArt Borrelia PCR Kit“ (www.artus-biotech.com) Naproti tomu malé a střední firmy soupravy pro standardní PCR, jednokrokovou i nested diagnostiku nabízí v širokém spektru stovek infekčních agens včetně BB, především na Internetu:PCR Praha OK s.r.o.= http://www.dnapcr.com/index.php?v=10, Genekam Biotechnology AG, www.genekam.de , Elizabeth Pharmacon ,EliGene, http://www.elisabeth.cz/kontakt.html , Maxim Biotech. Inc.dodává kity i s analýzou produktu = http://www.maximbio.com/genesearch.htm ) Milenia Biotec, dodává kit zároveň s následnou analýzou produktuhttp://www.milenia-biotec.deStandardní PCR je oblíbená pro nižší náklady na přístrojové vybavení a výrazně nižší provozní náklady na materiál. Při vhodném výběru specifické sekvence nukleotidů a při vhodné volbě metody a teplotního profilu amplifikace lze dosáhnout vysoké citlivosti i specifity za nižší cenu. V řadě případů však je třeba produkt amplifikace verifikovat následnou hybridizací značenou sondou, nebo restrikční analýzou, případně sekvenací produktu. Obliba této metodiky přináší stále pestřejší nabídku souprav na náš trh.Pokusíme se postupně vyzkoušet některé soupravy v naší laboratoři a s výsledky vás seznámit.
2.0.Materiál a metody
Pro vyzkoušení jsme objednali přes distributora v České republice (Biogen Praha) dvě soupravy PCR testu pro identifikaci Borrelia burgdorferi, GENEKAM Biotechnology AGČ. 018 , šarže 16:02:2005-01 v ceně za 299.-€ za jednu soupravu. Souprava je složena ze dvou plastikových krabiček s 12-ti eppendorfovými zkumavkami označnými písmeny A-G. Deklarované PCR zkumavky 0,2 ml (100 ks) uvedené v obsahu jsme neobrželi. Souprava se skladuje při – 20 ºC. K soupravám byl přiložen osmistránkový anglicky psaný návod se schématickými vyobrazeními.
2.1.Příprava DNA
DNA byla připravována pomocí komerčního kitu firmy QIAGEN ( QIAamp DNA Mini Kit)podle protokolu A a C pro izolaci DNA z gramnegativních bakterií, a protokolu D pro bakterie grampozitivní. Produktem byla směs nukleových kyselin s čistotou 1,5-2 (A 260/A280 nm) s výtěžkem 2-40 µg DNA v 1 ml. DNA byla připravována z krevní plasmy, synoviální tekutiny, mozkomíšního moku i z biopsií lidských tkání z objemu 2 ml tělní tekutiny ,respektive z 0,2-0,02 g tkáně.Získaný templát byl vyloužen do 400µl pufru AE (10mM Tris-Cl, 0,5mM EDTA ,pH 9,0) a uchováván při 4 ºC a při -20ºC do dvou měsíců po přípravě. Výjimkou v uchovávání byly roztoky DNA testovacích kmenů a testovacích sbírkových bakterií, které byly uchovávány při teplotě – 80 ºC v alikvótech i dva roky a více.
2.2.Testovací kmeny
2.2.1. Pozitivní sbírkové kmeny
Jako testovací pozitivní kmeny byly použity vybrané kmeny různých genomospeciés Borrelia burgdorferi sensu lato z kolekce Národní referenční laboratoře pro lymeskou Borreliózu, Centra epidemiologie a mikrobiologie Státního zdravotního ústavu v Praze. Genomová DNA byla připravována za použití komerčního kitu firmy QIAGEN podle protokolu C po kultivaci v BSK mediu SIGMA.
Borrelia burgdorferi sensu stricto ATCC 35210 kmen B31
Borrelia garinii(z mozkomíšního moku pacienta) kmen M192
Borrelia garinii (z mozkomíšního moku pacienta) kmen M310
Borrelia afzelii(z kůže pacienta) kmen Kc90
Jako další pozitivní kontrola byla použita složka označená jako D1 ze zkoušené soupravy patrně roztok DNA Borrelia burgdorferi sensu stricto.
2.2.2 Pozitivní DNA z klinických vzorků
Kontrolní DNA pozitivních pacientů z klinických vzorků byla vybrána tak, že musela splnit následující kriteria:
1.klinická diagnóza byla jednoznačně určena jako lymeská borrelióza DG A69.2
2.serologický průkaz specifických protilátek byl jednoznačně pozitivní jak v ELISA
testu tak v imunoblotu (WESTERNBLOT ) (WB)
3.ve vzorcích DNA těchto pacientů byla prokázána jak genomová DNA pomocí
LD primerů odvozených z genu 16SrRNA (3.) tak pozitivní plastidová DNA z genu OSPA (4)
4.vzorek byl pozitivní při přímém průkazu imunoelektronopticky(7)
2.2.3. Negativní DNA z klinických vzorků
Kontrolní DNA negativních pacientů z klinických vzorků pak byla vybrána tak, že musela splnit následující kriteria:
1.Klinická diagnosa vylučovala obraz lymeské borreliózy s Dg. A69.2
2.Serologické zkoušky (ELISA a WB) byly negativní.
3.Průkaz geonomové a plastidové DNA BB byl negativní při průkazu sekvencí odvozených od genu 16SrRNA i OSPA
4. Další přímý průkaz agens byl negativní (kultivačně i imunoelektroopticky)
2.2.4 Negativní kontrolní vzorky
Kontrolními negativními vzorky byly
a) u zkoušené soupravy roztok označený písmenem D2,
b) rozpuštědlo používané při přípravě referenčního testu PCR (apyrogenní sterilní destilovaná voda pro injectione BIOTIKA)
c) DNA připravená z lidské placenty (2,2 µg/1 ml a s čistotou 1,7 poměru A260/280 nm).
2.2.5. DNA bakterií pro test specifity
Autoři, kteří navrhli primery pro amplifikaci specifických sekvencí pro různé druhy bakterií mají také povinnost testovat úroveň specifity reakce. K testování přicházejí do úvahy především geneticky blízké druhy. U Borrelia burgdorferi jsou to příbuzné spirochéty rodů Leptospira ,Leptonema, Spirochaeta, Cristispira a Brachyspira a Borrelia. Od autorů primerů se dozvídáme,že testovali specifitu s DNA Borrelia hermsi, B.coriaceae, B.anserina, B.parkeri a B. turicatae, z jiných bakterií většinou též u Escherichia coli.(3,4,5)Mimo uvedené testuje se s DNA Treponema pallidum (5). Někteří výrobci kitů dokonce udávají specifiku s výčtem bakterií, které nedávají falešně pozitivní reakce. Je to například v případě firmy MILENIA BIOTEC u testu Milena GenLine Borrelia Direkt (EDMA Code 14-02-06-01). Tento výrobek udává i vysokou citlivost 1 genomekvivalent v l ml (tj. cca 20-50 fg) Výrobce vylučuje zkříženou reakci u následujících bakterií: Borrelia hermsii, Staphylococcus aureus, Staphylococcus epidermis, Chlamyda trachomatis, Mycobacterium avium, Corynebacterium glutamicum, Bacillus subtilis, Neisseria gonorrhoeae, Neisseria meningitidis, Pseudomonas aeruginosa, Streptococcus pneumonie Hemophilus influenzae a Escherichia coli.Pro příbuznost některých sekvencí fekálních bakterií se sekvencemi BB a pro možnost,že jejich buňky a DNA se mohou vyskytovat i ve vyšetřovaném klinickém materiálu byla použita k testování specifity DNA následujících sbírkových kmenů:
Escherichia coli EcK 141/59*
Proteus hauseri PrK 4/57*
Serratia marcescens Sr 20/61*
Yersinia enterocolitica Y 1/64*
Bacillus cereus Bc 8/78*
Corynebacterium murium Cor 35/70*
Enterobacter aerogenes Ae 1/43*
Micrococcus luteus M8/58*
Proteus mirabilis Prmi 26/77*
Staphylococcus aureus Mau 1/45*
*) CNCTC – Czechoslovak National Collection of Type Cultures, SZÚ Praha
2.3.Amplifikace
Pro srovnání výsledků byla použita referenční metoda multiplex PCR pro průkaz specifických oblastí sekvencí BB z genu 16SrRNA(LD) a OSPA .Využívá se komerčního mixu s horkým startem firmy QIAGEN (HotStarTaq Master Mix Kit) s 0,5µM každého ze setu primerů LD (2) a s 0,3µM každého primeru ze setu OSPA (3) . Koncentrace iontů Mg byla zvýšena na 2,0 mM. Používá se 20% templátu, reakce probíhá v objemu 25 µl v O,2 ml PCR zkumavkách.
Teplotní profil reakce: 1x 95 C 15 minut
35x 94 C 1 minuta
57 C 1,5 minuty
70 C 1,5 minuty
1x 72 C 10 minut
U srovnávaného kitu jsme se striktně drželi návodu. Dovolili jsme si pouze upravit teplotní profil reakce v druhém kroku kdy denaturaci jsme prováděli při 94 ºC a ne při „34º C“ jak požaduje návod.Při amplifikaci primerů LD a OSPA vzniká specifický produkt o velikosti 357 bp u LD primerů a 448 bp u OSPA.
Obraz 1: Specifičnost a citlivost referenční metody PCR –OSPA mutliplex PCR s horkým startem, která byla použita pro testování PCR kitu O18 GENEKAM specifický produkt odleva OSPA 448 bp a LD 357 bp.
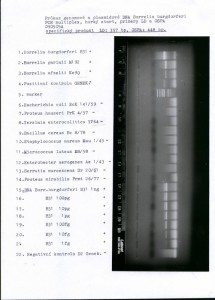
|
OSPA LD 1. Borrelia burgdorferi B31 + + 2. Borrelia garinii M192 - + 3. Borrelia afzelii Kc90 - + 4. Pozitivní kontrola GENEK.D1 + +
5. marker Top-Bio 155-970bp 6. Escherichia coli EcK 141/59 - - 7. Proteus hauseri PrK 4/57 - - 8. Yersinia entolocolitica Y 1/64 - -
9. Bacillus cereus Bc 8/78 - - 10.Staphylococcus aureus Mau 1/45 - - 11.Micrococcus luteus M8/58 - - 12.Enterobacter aerogenes Ae1/43 - -
13.Serratia marcescens Srov. 20/61 - - 14.Proteus mirabilis Prmi 26/77 - -
15.Borr. burgdorferi B 31 5 ng + + 16.B31 500 pg + + 17.B31 50 pg + +
18.B31 5 pg + + 19.B31 500 fg +- + 20.B31 50 fg - + 21.B31 5 fg - +-
22.negativní kontrola dest.voda - -
|
357 bp a 448 bp. U PCR kitu GENEKAM vzniká v prvním kroku produkt pouze při vysoké koncentraci specifické DNA o velikosti 371 bp, v druhém kroku je specifickým produktem amplifikát 236 bp.
3.0.Výsledky
3.1.Návod a informace
Návod navozuje pocit provizoria.Návod je v angličtině, není přeložen do jazyka země určení, což byť není dosud u nás pravidlem by přispělo k přesnější interpretaci pokynů i ve vědeckém prostředí. Na osmi stranách xerokopií je ve schématech s komentářem uveden postup při použití soupravy. Na rozdíl od firemního letáku je zde již správně uveden vědecký název testovaného organismu Borrelia burgdorferi. V nabídce je místo Borrelia uveden chybně tvar rodového jména jako „Borellia“. Šarže výrobku není uvedena na krabičce, ale je připsána rukou na návodu. Expirace udána není vůbec. Certifikát kvality podle ISO ani podle jiné normy není uveden.V návodu nejsou zmíněny licenční podmínky pro reakci PCR , pouze na propagačním tisku je uvedeno omezení „jen pro výzkumné účely“. Návod doporučuje roztoky po použití opět zmrazit na -20ºC, není však řečeno, kolikrát je možné roztoky opakovaně rozmrazovat a zmrazovat bez ztráty kvality. V návodu nejsou
specifikovány použité primery, ani není uveden gen z kterého jsou primery odvozeny. Podle našich zkušeností, především z počtu basí produktů (371bp v prvém kroku a 236 bp v druhém kroku) se jedná o jedny z nejstarších nested primerů odvozených z genu kodujícího P66 (6),velmi často použivaných ve starších pracích německých autorů. Součástí soupravy je i marker ve zkumavce označené písmenem E. V návodu je uvedeno pouze „marker 100bp“, lépe by bylo uvést jeho rozsah např. 10 pruhů od 100bp do 1000bp se zvýrazněným pruhem velikosti 500bp. Patrně jen tiskovou chybou je uvedeno barvivo „Ethium Bromide“ místo správného ethidium bromide. Zkratka TAE 1x pufr je mezi uživateli PCR jistě triviálním označením, nevadilo by uvést tento elektroforetický pufr identifikujícím popisem, což by umožnilo i vlastní přípravu tohoto jednoduchého a velmi používaného pufru, totéž platí o přesnějším určení druhu vazebného roztoku a především o druhu použité agarózy. I pouhým použitím doporučované„dobré“agarózy se může méně zkušený pracovník dostat do velkých problémů tím spíše, že doporučená koncentrace agarózy „3%“ může být podle druhu agarózy velmi málo i velmi mnoho. Není vhodné též nabádat výzkumníka, aby při elektroforéze užil 50 % objemu amplifikovaného mixu, když obecně se doporučuje 10-15% a na gelu je to také znát! Stejně tak doporučovat elektroforézu striktně jednu hodinu při 120V je nevhodné, neboť zásadně záleží na velikosti gelu a pro malou plochu to může být již příliš (produkt zmizí v přehřátém pufru) a pro velký gel je to zase příliš málo (srovnání velikosti produktu s kontrolou je nepřesné a může vést k chybným závěrům). Není vhodné též nezkušené nabádat, aby do první a poslední jamky na gelu dávaly velikostní marker. Právě v těchto místech dochází k nerovnoměrnému rozdělením, posunu a jiným deformacím, které poté mohou vést k rozpakům se správným hodnocením produktu. Věříme,že pouze chybou došlo na straně 6 návodu k chybnému uvedení teploty denaturace druhého kroku. Je zde uvedena teplota denaturace „34ºC“ místo potřebných 94ºC. Byla by to ovšem kritická chyba, možná,že výrobce předpokládá, že takové nesmysly si zkušený výzkumník opraví sám. Z uvedeného jsme na pochybách pro koho je souprava vlastně určena.
3.2.Adjustace
Rozdělení jednotlivých dodávaných roztoků do eppendorfových zkumavek označných samolepkami s písmeny A-G je jistě pro manufakturní výrobu velkého množství testů výhodné, na zákazníka to však dělá dojem výroby „na koleně“. Eppendorfky nejsou označeny na víčcích což znesnadňuje jejich identifikaci při velmi těsném uložení v plastikové krabičce. Zkumavky je nutné přemístit do dalšího stojánku, který by mohl být součástí dodávky, třeba z materiálu (např.pěnový polystyrén),který by déle udržoval potřebnou teplotu roztoků. Ke krabičce soupravy, která se skladuje při -20ºC se dodává i 100 ks PCR zkumavek, které se však takto oddělené mohou ztratit ,jako se stalo nám.
3.3.Specifita
Již v době, kdy jsme před několika lety testovali primery P 66 v nested PCR nás nemile překvapilo,že DNA Escherichia coli (Ec) je amplifikována stejně jako specifická DNA BB a výsledkem je velmi silný falešně pozitivní produkt v druhém kroku, bez další analýzy produktu neodlišitelný od produktu specifického. Ani zvýšení teploty anilingu nevedlo k odstranění falešně pozitivních produktů z DNA fekálních bakterií.Nyní se nám dostala do ruky souprava o které jsme netušili, že používá primerů P 66, ale první výsledky s DNA Ec nás opět přivedly k podezření,že se jedná o tento druh reakce i když to výrobce nikde neuvádí.
3.5.Falešná pozitivita
V testu byla falešná pozitivita zjištěna u DNA následujících sbírkových kmenů a templátů
Escherichia coli EcK 141/59
Proteus hauseri PrK 4/57
Yersinia enterocolitica Y 1/64
Enterobacter aerogenes Ae 1/43
Control template Bacteriophage Lambda genomic DNA
Applied Biosystems lot. 0404013 (8)
Control template DNA Escherichia coli
5501 Perkin Elmer Cetus
Toto zjištění by nám již stačilo, abychom označili výsledky soupravy za nevyhovující. Vyzkoušeli jsme ještě DNA z kontrolního templátu staré soupravy Core PCR Kit Perkin Elmer, který byl také připravován z DNA Ec. Bohužel výsledek by také falešně pozitivní. S ohledem na to že bakterie z čeledi Enterobacteriaceae mohou být přítomny i v klinickém materiálu a mohou být dokonce vlastním etiologickým patogenem, nelze test používat všude tam, kde se mohou tyto fekální bakterie vyskytovat a to jak v lidském i zvířecím materiálu, v klíšťatech , ve vodách a jinde. Tyto falešně pozitivní výsledky lze odstranit pouze při analýze PCR produktu hybridizací sondou, enzymatickou restrikční analýzou nebo sekvencí. Tato identifikace však není součástí soupravy a dokonce se o její nutnosti ani výrobce nezmiňuje.
3.4.Citlivost
Pro test citlivosti jsme použili genomovou DNA BB kmene B31 o koncentraci 2,2µg v 1 ml, tj. 2 ng v 1 µl. Ředěním pufrem AE QIAGEN desítkovou soustavou jsme při použití 2 µltemplátu v 20 µl reakční směsi zjišťovali citlivost 4000 pg až 40 fg. Podle opakovaného srovnání jsme byli schopni prokázat v druhém kroku nested PCR cca 400 fg borreliové DNA. Toto množství odpovídá genomům z 20 těl borrelií. Je to výsledek velmi dobrý i když citlivost za přítomnosti heterologní hostitelské DNA může být snížena. Při naší metodice
Obr.2. : Výsledek amplifikace nested PCR kitu 018 GENEKAM produkt amplifikace je 236bp. Popis podle jamek odzhora:
6. Escherichia coli EcK + 7. Bacillus cereus Bc - 8. Micrococcus luteus M - 9. Staphylococcus aureus - 10. Serratia marcescens - 11. Yersinia enterocolitica + 12. marker SIGMA 13. neg.pacient E434 - 14, neg.pacient E618 - 15. neg.pacient E647 - 16. neg.pacient E620 + 17. poz.pacient E137 + 18. marker SIGMA 19. poz.pacient E547 + 20. negat.kontrola D1 G - 21. negat.kontr.dest.voda - 22. dest.voda QIAGEN +
dosahujeme citlivosti s čistou bakteriální DNA citlivost o řád až dva řády vyšší, za přítomnosti hostitelské DNA je citlivost obou metodik srovnatelná. Citlivost pro průkaz specifické DNA ve tkáni, v synoviální tekutině, a v klíštěcím homogenátu je velmi dobrá. To se týká citlivosti v druhém kroku PCR reakce, v prvním kroku lze identifikovat jen zvlášť koncentrovanou DNA kmenů BB.Hraniční citlivost testu je v průkazu spirochét v krvi a mozkomíšním moku. S ohledem na přítomnost DNA koliformních bakterií v moči, fekáliích , nekropsiích a odpadní vodě je test pro tyto druhy materiálu nepoužitelný bez další analýzy produktu. S falešně pozitivním výsledkem jsme se setkali u 10 striktně vybraných pacientů jen v jednom případě u pacienta s roztroušenou sklerózou. V průběhu jednoho měsíce jsme vyšetřili paralelně 70 vzorků, tak jak přicházely do referenční laboratoře. V 77 procentech vzorků byly výsledky shodné.(Viz graf č.1) U šestnácti vzorků ze 70-ti(23%) jsme získali rozdílné výsledky. Se zkoušeným kitem bylo deset testů falešně negativních a šest falešně pozitivních.
Graf č.1
3.6.Falešná negativita
U striktně vybraného materiálu (5 pozitivních a 5 negativních vzorků v jednom pokuse s referenčním testem viz 2.2.2.) jsme se nesetkali ani s jedním případem falešně negativní reakce u zkoušeného testu. Dosud ne zcela objasněný je případ, kdy pomocí kitu nebylo možné opakovaně prokázat pozitivní reakci u izolátu sbírkového kmene Borrelia garinii M192, když stejná DNA reagovala pozitivně v primery LD,BG,( 3)cć a bb´(5 ). V tomto případě byla i dostatečná koncentrace specifické DNA v testu jako negativní a nejednalo se přitom o přítomnost inhibitorů, nebo nadbytek DNA.
4.0.Souhrn
Testovaný kit pro průkaz DNA Borrelia burgdorferi může být použitelný jako doplňkový test přímého průkazu původce lymeské borreliózy v lidských i zvířecích vzorcích Zjednodušuje metodiku průkazu . Podle srovnání s naší metodikou dosahuje vysoké procento shody výsledků (77%) při zachování vysoké citlivosti (i pod 400 fg). Produkt je snadno detegovatelný. Problémem výsledků může být nespecifičnost v situaci, kdy vzorek obsahuje DNA některých fekálních bakterií. To lze odstranit následnou analýzou produktu hybridizací specifickou sondou, restrikční analýzou nebo sekvenací.Je možné test doplnit ještě další PCR s primery z jiného genu Borrelia burgdorferi. Výrobce však nikde neupozorňuje na významné nebezpečí falešně pozitivních výsledků. Vybavení kitu druhově specifickou hybridizační sondou a lákavější adjustace ingrediencí s vylepšeným návodem by velmi pomohlo i této soupravě pro solidní využití v široké laboratorní praxi.
5. 0.Literatura
1. Wilske,B.,Zoller,L., Brade,V., et al. MIQ 12 Lyme-borreliose. In:Qualitatsstandards in der mikrobiologiích infectiologischen Diagnostik, Mauch,H.,Lutticken,R., eds.Munich: Urban and Fischer Verlag, 2000.
2. EUCALB Clinical Laboratory: Polymerase Chain Reaction
http://vie.dis.strath.ac.uk/vie/LymeEU/diagnosis-clinical-features-pcr.html
3. Marconi, T.R., Garon, C.F.,
Development of Polymerase Chain Reaction Primer Sets for Diagnosis of Lyme Disease and for Species-Specific Identification of Lyme Disease Isolates by 16SrRNA Signature Nukleotide Analysis.
Journal of Clinical Mikrobiology, Vol.30, No.11,Nov.1992, p.2830-2834
4. Manak, M.M., Gonsales-Villasenor,L.I., Aush-Stantore,S., and Tilton,R.,C.,
Use of PCR Essay to Monitor the Clearence of Borrelia burgdorferi DNA from Blood Following Antibiotik Therapy.
Journal of Spirochetal and Tick-borne Diseases, Vol.4, Num,1/2, Spring/Summer,1997
5. Rosa,P.A., Hogan, D., and Schwan, T.G.,
Polymerase Chain Reaction Analyses Identify Two Distinct Classes of Borrelia burgdorferi.
Journal of Clinical Mikrobiology, Vol.29, No.3, Mar.1991, p. 524-532
6. Rosa. P.A., and Schwan, T.G.,
A specific and sensitive assay for the Lyme disease spirochete Borrelia burgdorferi using the polymerase chain reaction.
J. Infect. Dis. 160: 1018-1029, 1989
7.(Hulínská,D., odkaz na metodiku přímé diagnostiky imunoelektronopticky)
8. GeneAmp Gold PCR Reagent Kit, P/N 4312778, Applied Biosystems


