Nové definované medium pro studium tvorby nukleáz u Serratia marcescens
Návrh definovaného media pro kultivaci Serratia marcescens při studiu produkce nukleáz.
Jiří Antonín Votýpka, Praha, 1973
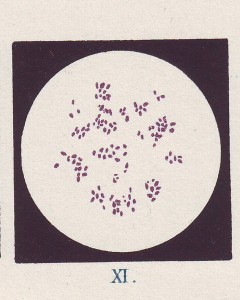
Serratia marcescens mikroskopický preparát bakterií z agarové půdy barvených fuchsinem
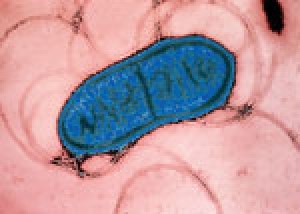
Dělící se buňka bakterie Serratia marcescens řez - znázorněno elektronovým mikroskopem a obarveno,modrá by měla spíš být růžová ale okolí to změnilo.
Originál snímku Pasteur Institut Paris
Úvod.
Výskyt a význam serácií v přírodě.
Význam druhu Serratia marcescens byl donedávna značně podceněn. Nejčastěji byl uváděn jako zajímavý příklad lipolytického organismu, neškodného saprofyta, fytopatogena, producenta prodigiósinu používaného k léčbě kokcidiomykóz a organismu používaného při vytváření anaerobního prostředí.
Seracie jako lidské pathogeny
Téměř závratně stoupl během posledních let výskyt infekcí, jejichž původcem byly prokazatelně kmeny Serratia marcescens. I přes tyto výsledky jsou někdy uváděny serácie jako organismy pro člověka nepatogenní nebo jejich etiopatogeneze je dosud nevyjasněná. O cíleném sledování serácií při rutinním vyšetřování nemůže být ani dnes řeči. Nedávno byly v zahraničí navrženy nové selektivní a diagnostické živné půdy pro izolaci serácií pro rutinní vyšetřování klinického materiálu.

Narostlá kultura na povrchu sterilního bramboru pěstovaná 8 dní při 22 C, mimo výrazné krvavé barvy je typický kovový,zlatitý lesk na povrchu.
Léčba zhoubných nádorů při použití serácií
Již dlouhou dobu je využívána serácie při léčbě zhoubných nádorů. Je součástí Coleyových toxínů, které se aplikují různým způsobem při léčbě některých neoperovatelných zhoubných nádorů. Výrazné úspěchy při léčbě byly podnětem pro studium serácií. Postupem času byly zkoušeny i jiné rody a druhy mikroorganismů v tzv.MBT látkách. Vysvětlení účinku Coleyových toxínů a MBT látek v regresi nádorů se pokouší objasnit hypotéza o nespecifické stimulaci imunogenního systému organismu, obecně přijatá. Vznikla však i hypotéza, která počítá s uplatněním mimobuněčných nukleáz, respektive deoxyribonukleáz a ribonukleáz.(9)

Krvavě rudá barva masivně narostlé kultury na povrchu agarové půdy za 4 dny při 222 C
Produkce enzymů štěpící nově tvořenou a nádorovou DNA
Pro studium produkce a aktivity produkovaných nukleáz u různých kmenů serácií je nutné, aby kultivační prostředí bylo dostatečně saturováno živinami a neobsahovalo složky inhibující tvorbu nukleáz. Zároveň nesmí být medium toxické pro lidské buňky. Pro zjednodušení imunologického hodnocení produkovaných látek, by neměla živná půda obsahovat žádné antigenní složky. Vzhledem k tomu,že většina komplexních živných půd obsahuje antigenní složky (například tyrosin) byla pozornost věnována syntetickým definovaným mediím. V novější literatuře bylo nalezeno 22 plně definovaných minerálních medií pro kultivaci různých enterálních mikroorganismů, některé byly určeny přímo pro kultivaci druhu Serratia marcescens. Většina je určena pro tvorbu pigmentu – marcesceinu. Jsou buˇpříliš nutričně chudá, osmoticky neodpovídají poměrům in vivo, nebo obsahují citráty , případně i různé antigeny. Obsah citrátů v živné půdě, kde má být studována mimobuněčná nukleáza je nepřijatelný. Je známo, že citrany patří ,mezi inhibitory například deoxyribonukleáz.
Originální definované medium pro studium nukleáz u serácií
Protože nebylo nalezeno v literatuře vhodné medium pro studium vztahu nukleázy serácií a nádorových buněk, bylo po pokusech sestaveno a prověřeno nové vhodné živné medium tohoto složení označené jako SM:
Rp. NaCl 1,4g, KCl 1.0g, MgSO4.7H2O 0,2g, l-ornithin 0,1g, l-asparagin 1.0g, glukosa 10,0g destilovaná voda 1000 ml.
Jednotlivé složky postupně rozpustíme zahříváním, hodnotu pH (je kolem 5,0) neupravujeme, sterilizujeme autoklávováním 10 minut při 121 C. Po ochlazení přidáme asepticky sterilní roztok K2HPO4 (10 %ní) tak aby konečná koncentrace činila v médiu 0,5 % . V případě, že chceme zvýšit produkci nukleáz je vhodné zvýšit obsah MgSO4.7H2O do konečné koncentrace 0,5 % pro ochranu nukleáz lze přidávat po sterilizaci sterilní roztok jodidu draselného až do koncentrace 0,1 %. Zvýšením obsahu K2HPO4 do finální koncentrace 1 % se podpoří tvorba pigmentu.
Lze též připravit pevné agarové SM medium:
Navážku substancí pro SM medium na jeden litr přidáme k 500 ml destilované vody a sterilizujeme výše uvedeným způsobem.Množství agaru na jeden litr (1-2% podle druhu agaru) přidáme k 500 ml destilované vody, necháme nabobtnat 20 minut, rozvaříme při 100 C za 40 minut a sterilizujeme autoklávováním při 121 C po dobu 20 minut. Sterilní složky ochlazené na 60 C smísíme. Přidáme stejné množství roztoku K2HPO4 jako do tekutého media, důkladně promícháme bez tvorby pěny a rozléváme do sterilních Petriho misek.
Po naočkování inkubujeme nejlépe při 20-23 C při denním osvětlení. Lze též rychleji dosáhnout růstu i při 37 C ve tmě.
Strana 127 věnovaná Bacterium prodigiosum jak se dříve označovala Serratia marcescens v níže citované publikace
Obrazky zde z publikace Lehmann-Neumann: Bakteriologische Diagnostik
J.F.Lehmanns Verlag Munchen 1927
Celý text práce viz stránky „Já“
http://www.ja.webzdarma.cz/index.php?st=text&nd=22

